- Главная
- Оборудование для печатных плат
- Оборудование для поверхностного монтажа
- Технологии производства плат и поверхностного монтажа
- Инструмент для печатных плат и Запасные части
- Материалы и Химикаты для печатных плат и поверхностного монтажа
- Гальваническое оборудование
- Лабораторное и аналитическое оборудование
- Сервис и техническое обслуживание
- Как нас найти
- Начало раздела
- Оборудование
- Поддержка
- Справка
- Контакты
Иммерсионное золочение - вопросы и ответы
Продавая тот или иной техпроцесс, фирма-поставщик никогда не раскрывает все секреты своих разработок, и поэтому технологу зачастую приходится самому находить ответы на возникшие вопросы. В статье рассматривается пример освоения технологии иммерсионного золочения.
Как правило, купив импортный техпроцесс, изготовитель печатных плат получает Know-How (подробное описание техпроцесса) и химикаты для составления и корректировки растворов. Однако при этом некоторые вопросы, необходимые технологу при освоении техпроцесса, остаются открытыми. Так, при освоении техпроцесса Aureus фирмы Shipley у нас возник целый ряд вопросов, ответы на которые пришлось искать самостоятельно.
В процессе контактного замещения золото из дицианоаурат-иона восстанавливается до металла, а цианид-ионы высвобождаются по реакции:
2[Au(CN)2]- + Ni →
→ 2Au + 4CN- + Ni2+.
Поэтому возникает
- вопрос 1: «Имеются ли в рабочем растворе иммерсионного золочения свободные цианиды ?» Ответ на этот вопрос имеет принципиальное значение, так как определяет, к какому классу опасности относятся вещества, выделяющиеся из раствора при его эксплуатации, и какие меры по технике безопасности должны быть приняты, чтобы работа на линии не представляла вреда для здоровья обслуживающего ее персонала. C наличием или отсутствием в растворе иммерсионного золочения свободных цианид-ионов тесно взаимосвязан
- вопрос 2: «В виде какого химического соединения в растворе находится никель?» Известно [2], что ионы Ni2+ образуют с цианид-ионами очень прочные комплексные соединения [Ni(CN)4]2- с константой устойчивости b4 = 31,0. Поэтому естественно было предположить, что оба побочных продукта реакции контактного замещения (Ni2+ и CN-) будут вязываться в прочный комплекс, и тогда свободных цианидов в растворе не должно быть. Если же свободные цианиды по каким-либо причинам с никелем не связываются, то они обязательно должны присутствовать в растворе золочения.
В процессе эксплуатации раствора золочения в нем происходит накопление двухвалентного никеля. В связи с этим возникают сразу два вопроса:
- вопрос 3: «До какой предельной концентрации никель может накапливаться в растворе, не ухудшая качества покрытия?»
- вопрос 4: «Каким методом можно контролировать концентрацию никеля в растворе золочения?»
Для установления факта наличия или отсутствия в рабочем растворе золочения свободных цианид-ионов были проведены качественные реакции пробы раствора с азотнокислым серебром и йодидом калия [3].
Если бы в рабочем растворе золочения присутствовали свободные цианиды, то добавление ионов серебра приводило бы к образованию белого осадка:
Ag+ + CN- ® →AgCN.
Однако образования осадка цианида серебра не произошло, и раствор пробы остался прозрачным.
В присутствии добавленного к пробе йодида калия уже первая капля азотнокислого серебра привела к образованию желтого осадка йодида серебра:
Ag+ + J-→ AgJ![]()
Это свидетельствует о том, что в растворе пробы нет других свободных анионов, кроме йодидов, с которыми ионы серебра вступили бы в реакцию. Проведенные тесты позволяют с уверенностью утверждать, что в рабочем растворе золочения свободных цианидов нет, а высвобождающиеся цианид-ионы связываются с ионами никеля в прочный комплекс [Ni(CN)4]2-. Из этого следует, что в рабочем растворе золочения есть только комплексно связанные цианиды: [Au(CN)4]2- и [Ni(CN)4]2-, и реакция контактного замещения должна быть записана следующим образом:
2[Au(CN)2]- + Ni →
→ 2Au + [Ni(CN)4]2-.
Косвенным подтверждением сделанного вывода является то обстоятельство, что в рабочем растворе золочения, в котором должно было бы накопиться уже довольно значительное количество двухвалентного никеля, невозможно определить его содержание объемным комплексонометрическим методом, каким он легко определяется, например, в растворе химического никелирования.
Это происходит потому, что прочность комплекса никеля с цианид-ионами значительно больше, чем с этилендиаминтетраацетат-ионом (lg Beta = 18,62) [2] и в процессе титрования этилендиаминтетраацетат натрия (трилон Б) не может разрушить более прочный цианидый комплекс никеля. То есть, комплексонометрическим методом никель в растворе иммерсионного золочения определить нельзя.
Традиционный весовой метод с применением диметилглиоксима или его аналогов также не подходит по причине более низкой прочности комплексов никеля с этими реагентами по сравнению с цианидным комплексом.
Определение никеля в растворе золочения может быть проведено атомно-абсорбционным или спектральным методом, но для этого необходимо иметь соответствующее оборудование.
Для определения содержания никеля в растворе золочения в ИТМ и ВТ был предложен расчетный метод по количеству золота, израсходованного на реакцию контактного замещения. Поскольку Ni(II) появляется в растворе золочения только как следствие протекания этой реакции, то по расходу золота можно рассчитать концентрацию Ni (II) в ванне.
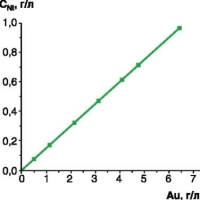
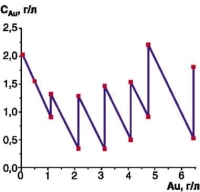
В таблице 1 представлены результаты этого расчета, а на рисунке 1 — зависимость концентрации никеля от расхода золота. Как видно из рисунка 1, концентрация никеля возрастает прямо пропорционально расходу золота. Концентрация золота в растворе изменяется скачкообразно (см. рис. 2): падает во время золочения и резко возрастает при корректировке.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Таблица 1. Зависимость концентрации никеля в растворе иммерсионного золочения от расхода золота |
||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||||||||
| Рис. 1. Зависимость концентрации никеля в ванне золочения от расхода золота | Рис. 2. Изменение концентрации золота в ванне золочения за один из периодов ее эксплуатации | |||||||||||||||||||||||||||||||||||||||||||||
Принимая во внимание характер изменения концентраций золота и никеля в процессе эксплуатации раствора золочения, был сделан практический вывод, что на качество покрытия влияют не абсолютные значения концентраций этих металлов, а их мольные соотношения (соотношения концентраций, выраженных в М/л). Из таблицы 2 видно, что эти соотношения также изменяются скачкообразно, однако при увеличении срока эксплуатации раствора прослеживается тенденция к падению соотношения Au/Ni. Это связано с тем, что концентрация Au(I) в растворе колеблется внутри заданного рабочего интервала (2,0...0,5 г/л), а концентрация Ni(II) непрерывно возрастает.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Таблица 2. Изменение соотношения концентраций золота и никеля в ванне золочения за один из периодов ее эксплуатации |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Обычно за меру старения раствора принимают число оборотов металла, прошедшего через раствор: меtаl turnover либо, сокращенно, МТО. Если в раствор с корректировкой введено исходное количество металла, то это означает, что через раствор прошел 1 оборот металла.
В документации техпроцесса Aureus [I] сказано, что раствор следует заменить после введения в него с корректировкой 3,15 г/л золота. Учитывая, что исходная концентрация золота в ванне — 2,0 г/л, то введение 3,15 г/л золота соответствует 1,57 МТО.
В то же время в других информационных источниках приводится длительность эксплуатации раствора иммерсионного золочения в 3 [4] и даже 4 [5, 6] МТО. Поэтому возник 5 вопрос: «Можно ли увеличить срок эксплуатации раствора золочения без ухудшения качества покрытия ?»
Как уже было сказано выше, главным фактором, сокращающим время жизни раствора золочения, является накопление в нем никеля в виде тетрацианоникелатного комплекса. Поэтому для нахождения оптимального срока службы раствора необходимо было установить минимально допустимое соотношение Au/Ni, при котором обеспечивается хорошее качество покрытия.
Для этого был применен расчетно-графический метод. Зависимость соотношения Au/Ni от величины расхода золота строили при условии, что каждой величине расхода золота может соответствовать любое значение концентрации золота внутри заданного рабочего интервала. Концентрацию золота изменяли дискретно через 0,25 г/л. Величины расхода золота пересчитывали на концентрацию никеля и находили соотношения Au/Ni.
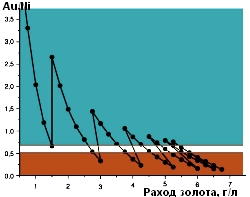
В результате было выявлено три зоны функционирования раствора золочения (см. рис. 3).
- Зеленая зона — рабочая. Соотношения Au/Ni в пределах этой зоны являются благоприятными и обеспечивают получение покрытия хорошего качества.
- Желтая зона — промежуточная. Если соотношение Au/Ni попадает в эту зону, то раствор следует откорректировать.
- Красная зона — нерабочая. Соотношения Au/Ni в этой зоне являются неблагоприятными и не обеспечивают требуемое качество покрытия.
 |
|
Рис. 3. Зоны функционирования раствора золочения |
Для того чтобы не попасть в красную зону, необходимо каждый последующий этап корректировки производить при более высоком нижнем значении концентрации золота, повышая его каждый раз на 0,25 г/л. То есть, при помощи аналитического контроля и своевременной корректировки раствора дицианоауратом калия необходимо поддерживать концентрацию золота в следующих рабочих интервалах:
- 2,0 г/л — 0,5 г/л на 1 этапе корректировки;
- 2,0 г/л — 0,75 г/л на 2 этапе корректировки;
- 2,0 г/л — 1,00 г/л на 3 этапе корректировки;
- 2,0 г/л — 1,25 г/л на 4 этапе корректировки;
- 2,0 г/л — 1,50 г/л на 5 этапе корректировки;
- 2,0 г/л — 1,75 г/л на 6 этапе корректировки.
С помощью предлагаемого приема можно продлить срок эксплуатации раствора золочения до величины расхода золота 5,5 г/л, что соответствует 2,75 МТО. За это время никель накапливается в растворе до концентрации 0,82 г/л, которая и является предельной. Дальнейшее продление срока службы раствора золочения нецелесообразно, так как приведет к тому, что соотношение Au/Ni станет неблагоприятным (красная зона) и не обеспечит получение покрытия хорошего качества.
К техпроцессу Aureus [I] были приложены графики зависимости толщины золотого покрытия от времени золочения (см. рис. 4). Из рисунка 4 видно, что толщина покрытия, полученного за одно и то же время из свежего раствора, больше, чем из раствора с длительным сроком эксплуатации.
В связи с этим возникает 6 вопрос: «Почему толщина золотого покрытия при увеличении срока эксплуатации раствора уменьшается?»
Процесс золочения с учетом проведенных тестов выражается уравнением:
2[Au (CN)2]- + Ni →
→ 2Au + [Ni (CN)4]2-.
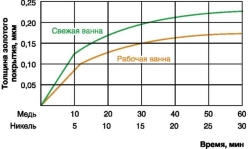 |
| Рис. 4. Зависимость толщины золотого покрытия от времени золочения на медном и никелевом подслое |
Выражение для константы равновесия реакции выглядит следующим образом:
[Ni(CN)42-] [Au]2
Краен. = -------------------------------------
[Au(CN)2-]2- [Ni]
Для теоретического анализа выражения для Краен. введем некоторые допущения. Пусть в растворе в начальный (I) и завершающий период (II) его эксплуатации проводится золочение заготовок с одинаковой площадью металлизации, то есть SI = SII = S.
Пусть также концентрация золота в ванне в первом и во втором эксперименте за счет корректировки поддерживается на одном и том же уровне, то есть:
[Au(CN)II]2 = [Au(CN)2]II = Const. Количество удаляющегося с поверхности заготовки никеля и осаждающегося на поверхность заготовки золота можно выразить через площадь металлизации S, толщину покрытия h и удельный вес d:
PNi = SNihNidNi; PAu = SAu hAu dAu .
Если теперь разделить P на объем ванны (V),то получим выражения для [Au] и [Ni]:
[Ni] =SNihNidNi/V.
[Au] = SAuhAudAu/V
Так как золото высаживается на покрытый никелем рисунок, то:
SNi = SAu = S.
Толщины hAu и hNi также равны, поскольку в реакции контактного замещения атомы золота встают на место ушедших с поверхности атомов никеля.
Если теперь в выражение для Кравн. подставить указанные выше величины, то получится следующее уравнение:
[Ni(CN)4]2-S2h2d2AuV
Кравн. = ----------------------------------------------- =
Const S h dNi V2-
[Ni(CN)4]2- Shd2Au
= -----------------------------------------------
Const V dNi
В полученном выражении для Кравн. все величины кроме [Ni(CN)4]2- и h являются постоянными. При увеличении срока эксплуатации раствора концентрация [Ni(CN)4]2- будет возрастать. Поэтому для того, чтобы Кравн. оставалась величиной постоянной, толщина покрытия h должна уменьшаться.
Таким образом, толщина золотого покрытия, полученного за одно и то же время, из ванны с одной и той же концентрацией золота, но в более поздние сроки ее эксплуатации, будет снижаться. Экспериментально это было подтверждено методом зондового рентгеноспектрального анализа [7].
ВЫВОДЫ
- Раствор иммерсионного золочения техпроцесса Aureus фирмы Shipley не содержит свободных цианид-ионов.
- Раствор золочения не содержит свободных ионов Ni2+.
- Ионы Ni2+ связываются с высвобождающимися в результате реакции цианид-ионами в прочный комплекс [Ni(CN)4]2-.
- В растворе золочения есть только комплексно связанные цианид-ионы: [Au(CN)2]- и [Ni(CN)4]2-.
- Предложен расчетный метод определения концентрации никеля в растворе золочения по величине расхода золота.
- Найдена предельная концентрация — 0,82 г/л, до которой никель может накапливаться в растворе золочения.
- Установлено, что качество покрытия определяют не абсолютные значения концентрации золота и никеля в растворе золочения, а их мольные соотношения.
- За счет постепенного сужения рабочего интервала путем поднятия нижней границы концентрации золота в ванне срок службы раствора золочения может быть увеличен почти вдвое без ухудшения качества покрытия.
- Оптимальный срок службы раствора золочения, установленный расчетно-графическим методом, соответствует расходу золота 5,5 г/л, что составляет 2,75 МТО.
- Согласно теоретическому анализу выражения для Кравн. толщина золотого покрытия, полученного за одно и то же время из ванны с одинаковой концентрацией золота, но в более поздние сроки ее эксплуатации, будет уменьшаться.
- Aureus Prozes Manual, техпроцесс фирмы Shipley, 1995 г.
- Лурье Ю.Ю. Справочник по аналитической химии, «Химия», М., 1971 г., стр. 265.
- Жендарева О.Г., Мухина З.С. Методы анализа гальванических ванн. Оборонгиз, М., 1963 г., стр. 16.
- Мартин Хеинк. Различные способы защиты поверхности. Тезисы докладов на международной конференции «Печатные платы 2001», ООО «Петрокоммерц», Санкт-Петербург, 2001 г.
- Ronamerse SMT, Electroless Nickel — Immersion Gold Technology, проспект фирмы Lea Ponal, 1996г.
- Процесс нанесения защитного покрытия «химический никель—иммерсионное золото» NIRUNA. Доклад фирмы OMG Германия на 6-й Международной выставке ЕХРО ELECTRONICA, Москва, май, 2003 г.
- Е. Николаева. Дефекты финишного покрытия «химический никель—иммерсионное золото». Производство электроники, 2006г,




