- Главная
- Оборудование для печатных плат
- Оборудование для поверхностного монтажа
- Технологии производства плат и поверхностного монтажа
- Инструмент для печатных плат и Запасные части
- Материалы и Химикаты для печатных плат и поверхностного монтажа
- Гальваническое оборудование
- Лабораторное и аналитическое оборудование
- Сервис и техническое обслуживание
- Как нас найти
- Начало раздела
- Оборудование
- Поддержка
- Справка
- Контакты
Входной контроль солей винной кислоты при работе с тартратным раствором химического меднения
Тартратные растворы химического меднения широко применяются в производстве печатных плат. В качестве комплексообразующего лиганда в них обычно используется четырехводный калий-натрий виннокислый (KNaC4H4O6 • 4H2О). В настоящей работе показано, что для химического меднения подходит только определенный стереоизомер винной кислоты. Продукция, поступающая на рынок, информации о виде изомера часто не содержит. Поэтому необходим входной контроль для приемки каждой новой партии химиката.
С середины 90-х годов на российском рынке появилось много поставщиков четырехводного калия-натрия виннокислого. Опыт показал, что поступающая на рынок продукция различается по названию, квалификации чистоты, содержанию примесей, кристаллической структуре, растворимости в воде и другим показателям (в качестве примера см. табл. 1).
|
Название
|
Квалификация
|
Поставщик (дистрибьютор)
|
Страна изготовитель
|
|
Калий-натрий винно-кислый 4-водный
|
хч
|
НИИ «ХИМТЕХ»
|
Россия
|
|
ROCHELLE SALT
|
FOOD GRADE
|
ЗАО «КУПАВНА-РЕАКТИВ»
|
Голландия
|
|
WINIAN SODOWO POTASOWY
|
Spozywczy
|
«STANDARD» POLAND
|
Италия
|
|
Калий-натрий винно-кислый, 4-водный
|
чда
|
АО «ЭКРОС»
|
Россия
|
|
POWDER ROCHELLE SALT
|
—
|
ЗАО «КУПАВНА-РЕАКТИВ»
|
Франция
|
|
Калий-натрий винно-кислый, 4-водный
|
чда
|
АО «РЕАХИМ»
|
Франция
|
|
Бутан-дикарбоксикислота, 2-3-монокалия,
|
Фарма-
|
OYALGOLAB, Финляндия
|
|
|
мононатриевая соль, тетрагидрат
|
копейный
|
||
|
ROCHELLE SALT
|
—
|
ЗАО «КУПАВНА-РЕАКТИВ»
|
Италия
|
|
Калий-натрий винно-кислый, 4-водный
|
ч
|
«ХИММЕД»
|
Россия
|
|
Калий-натрий тартрат тетрагидрат
|
хч
|
«ХИММЕД»
|
Германия
|
Таблица 1. Химикаты, поступавшие на склад ИТМ и ВТ за последние 10 лет
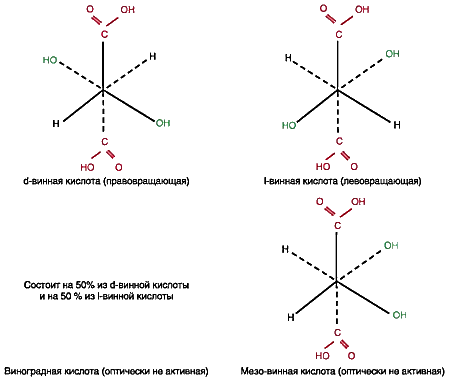
Положение осложняется еще и тем, что винная кислота и ее соли существуют в виде четырех стереоизомеров (см. рис. 1), которые различаются между собой физико-химическими характеристиками (см. табл. 2) [1].
|
Свойство
|
d-винная кислота
|
l-винная кислота
|
Виноградная кислота
|
Мезо-винная кислота
|
|
|
Темепратура плавления, °C
|
170
|
170
|
206
|
160
|
|
|
Плотность при 20°С, г/см3
|
1,760
|
1,760
|
1,697
|
1,737
|
|
|
Растворимость в 100 г воды при 20°С, г
|
139
|
139
|
20,6
|
125
|
|
|
Константы диссоциации
|
К1
|
1,17•10-3
|
1,17•10-3
|
1,1•10-3
|
0,77•10-3
|
|
К2
|
5,9•10-5
|
5,9•10-5
|
5,8•10-5
|
1,6•10-5
|
|
|
Угол вращения плоскости поляризации [a]20D
|
+12°
|
-12°
|
—
|
—
|
|
|
Кристаллическая структура
|
Моноклинная
|
Моноклинная
|
Ромбическая
|
Пластинчатая
|
|
Таблица 2. Физико-химические свойства стереоизомеров винной кислоты
Молекула каждого изомера состоит из двух параллельных плоскостей: сплошными линиями на рисунке соединены атомы, лежащие в верхней плоскости, а пунктирными линиями — атомы, лежащие в нижней плоскости. В центрах обеих плоскостей находятся атомы углерода. Из рисунка 1 видно, что стереоизомеры отличаются друг от друга пространственным расположением функциональных групп. Это и определяет различия в их способности к комплексообразованию с ионом двухвалентной меди.
Информация о виде изомера и его массовой доле в поставляемом химикате часто отсутствует и на этикетках, и в прилагаемых сертификатах. Методика определения массовой доли основного вещества, приведенная в ГОСТе [2], также не позволяет различить изомеры.
Поэтому для выяснения пригодности конкретной партии соли винной кислоты для процесса химического меднения требуется тестовая методика входного контроля химиката.
Для разработки такой методики необходимо, в свою очередь, знать как состав комплекса меди, образующегося в тартратных растворах химического меднения, так и его строение. Иными словами, надо иметь представление о том, с какими функциональными группами в молекуле винной кислоты (или ее соли) связан ион двухвалентной меди. Знание пространственного строения комплекса дает возможность понять, почему одни изомеры винной кислоты образуют комплексы с ионом Cu2+, а другие не образуют, то есть решить, какие соли пригодны для процесса химического меднения, а какие — нет.
В работах [3, 4] было установлено, что в щелочной среде (рН = 10—13,5) ионы двухвалентной меди образуют с тартрат-ионами комплекс Cu(OH)2 Т2- с константой устойчивости рК = 19,14.
Вопрос о строении данного комплекса до конца не выяснен [5]. В настоящей работе для изучения строения указанного комплекса был применен метод, заключающийся в компьютерном моделировании возможных пространственных конфигураций комплекса с одновременным квантово-химическим расчетом их потенциальной энергии при помощи программы GAMESS [6].
Потенциальная энергия комплекса является мерой напряженности структуры. Чем меньше величина потенциальной энергии той или иной структуры, тем больше вероятность ее существования.
В молекуле винной кислоты (см. рис. 1) имеются 4 функциональные группы (две карбоксильные и две гидрок-сильные), каждая из которых может взаимодействовать с ионом двухвалентной меди.
При образовании комплекса Cu(OH)2 Т2- могут получаться 4 структуры различной конфигурации:
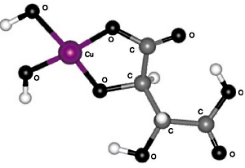
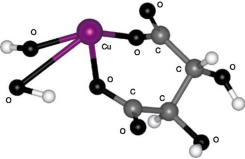
I. 5-членный цикл с участием карбоксильной и гидроксильной групп, расположенных у одного углеродного атома (см. рис. 2);
II. 5-членный цикл с участием двух гидроксильных групп (см. рис. 3);
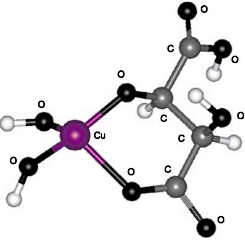
III. 6-членный цикл с участием карбоксильной и гидроксильной групп, расположенных у соседних углеродных атомов (см. рис. 4);
IV. 7-членный цикл с участием двух карбоксильных групп (см.рис. 5);
Из сравнения значений потенциальной энергии всех четырех структур (см. табл. 3) следует, что дигидроксотартрат меди имеет структуру I, состоящую из 5-членного цикла с участием карбоксильной и гидроксильной групп, расположенных у одного углеродного атома.
 |
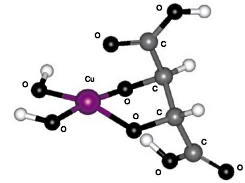 |
| Рис. 2. Структура I:5-членный цикл с участием карбоксильной и гидроксильной групп, расположенных у одного атома углерода | Рис. 3. Структура II: 5-членный цикл с участием двух гидроксильных групп |
 |
 |
|
Рис. 4. Структура III: 6-членный цикл с участием карбоксильной и гидроксильной групп, расположенных у соседних атомов
|
Рис. 5. Структура IV: 7-членный цикл с участием двух карбоксильных групп |
|
Тип структуры
|
Потенциальная энергия, ккал/моль
|
|
I
|
0
|
|
II
|
57
|
|
III
|
20
|
|
IV
|
40
|
Таблица 3. Значения потенциальной энергии структур
Сравнение геометрии стереоизомеров винной кислоты (см. рис. 1) с полученными данными о строении дигидроксотартрата меди свидетельствует о том, что:
- d-винная кислота может образовать структуру I;
- l-винная кислота структуру I образовать не может из-за стерических препятствий;
- виноградная кислота, состоящая на 50% из d-винной кислоты и на 50% из l-винной кислоты, может образовать структуру I только за счет d-кислоты, и поэтому взаимодействует с медью только 50% массы;
- мезо-винная кислота имеет такое геометрическое строение, что верхняя половина ее молекулы соответствует d-винной кислоте, а нижняя половина молекулы — l-винной кислоты . Поэтому она может образовать структуру I только за счет верхней половины.
Отсюда следует, что:
- в процессе химического меднения следует применять соль калия-натрия d-винной кислоты (технические названия — сегнетова соль, соль Рочелле);
- соль l-винной кислоты в процессе химического меднения применять бесполезно, так как она не образует комплекс с двухвалентной медью;
- соль виноградной кислоты применять в процессе химического меднения нецелесообразно, так как требуется удвоенное количество химиката;
- соль мезо-винной кислоты применять в процессе химического меднения также нецелесообразно по причине высокой стоимости химиката.
В химической лаборатории ИТМ и ВТ введен входной контроль каждой новой партии соли.
Входной контроль заключается в тестовом анализе пробы химиката, при котором, во-первых, проверяется способность данной виннокислой соли образовывать дигидроксотартрат меди и, во-вторых, изучаются спектральные характеристики полученного комплекса (вид спектра поглощения, положение максимума, оптическая плотность в максимуме поглощения). Для этого готовят три раствора:
- 0,1М-раствор CuSO4•5H2O;
- 0,1М-раствор KNaC4 H4O6x х 4H2O (анализируемый химикат);
- 1,0М-раствор NaOH.
В мерную колбу емкостью 100 мл последовательно приливают 20 мл раствора сульфата меди, 20 мл раствора анализируемого химиката и 10 мл раствора едкого натра. После растворения образовавшегося осадка раствор доводят до метки дистиллированной водой, перемешивают и снимают его спектр поглощения в интервале длин волн 400...800 нм в кювете с толщиной слоя 1 см. В качестве раствора сравнения используют дистиллированную воду.
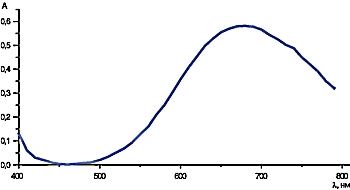
Если анализируемый химикат представляет собой d-изомер винной кислоты, то спектр поглощения указанного раствора имеет вид, представленный на рисунке 6. В случае виноградной и мезо-винной кислоты спектральные характеристики комплекса будут иными. Если же химикат является l-изомером, то выпавший при смешении растворов осадок не растворяется, так как комплекс не образуется.
 |
|
Рис. 6. Спектр дигидроксотартрата меди
|
При входном контроле химиката проверяется также его растворимость в воде. Наличие взвешенных частиц в растворе недопустимо, поскольку в процессе химического меднения они будут провоцировать протекание реакции в объеме раствора. Химикат, образующий мутные растворы или нерастворимые осадки, должен быть забракован.
Квантово-химический расчет потенциальной энергии возможных структур комплексов выполнен на Химическом факультете МГУ под руководством заведующего лабораторией химической кибернетики, д.х.н., профессора Немухина А.В.
ЛИТЕРАТУРА
- Неницеску К.Д. Органическая химия// М. Издательство иностранной литературы. 1963, т. 1, с. 37.
- Калий-натрий виннокислый 4-водный. ГОСТ 5845-79.
- Тихонов А.С., Вельская В.П. Исследование реакций комплексообразования двухвалентной меди с ионами винной кислоты//Сборник статей по общей химии. 1953, т. 11, с. 1201.
- Pavlovic Z.M., Losic D.N. Kompleksi bakra (II) u alkalnoj otopini u prisustvu tartorat iona//Гласник xemujckoг друштва. Белград, 1979, 44 (II), с. 695.
- Schoenberg L.N. The Structure of the Complexed Copper Species in Electroless Copper Plating Solutions//J. Electrochem Soc., 1978, v. 10, p. 1571.
- Schmidt M.W., Baldridge K.K. и др. J. Comput. Chem, 1993, 14, 1347.




